La maladie d’Alzheimer se manifeste notamment par l’agrégation de fragments protéiques nommés peptides bêta-amyloïdes autour des neurones. Ces fragments sont découpés dans la protéine APP par l’enzyme BACE-1, toutes deux abondantes dans le cerveau. Pourquoi ne déclenchent-elles pas alors systématiquement la maladie ? Utpal Das, de l’Université de Californie, et ses collègues l’expliquent par leur compartimentation au sein du neurone, séparation qui empêche leur interaction.
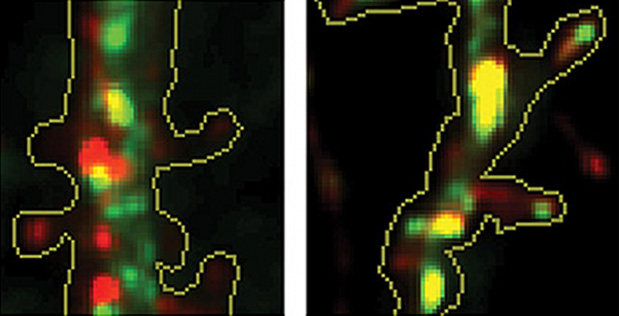
Les chercheurs ont cultivé des neurones d’hippocampe (une aire cérébrale essentielle à la mémoire, particulièrement atteinte lors de la maladie d’Alzheimer) de souris. Ils les ont modifiés génétiquement pour qu’ils produisent des protéines APP et des enzymes BACE-1 fluorescentes, respectivement vertes et rouges. Ils ont ainsi constaté qu’après leur synthèse, ces molécules étaient stockées dans des vésicules séparées.
Ils ont ensuite stimulé l’activité électrique des neurones afin d’en étudier les conséquences sur la compartimentation. L’accroissement de l’activité neuronale est connu pour entraîner une plus grande agrégation des peptides bêta-amyloïdes. Cela peut sembler contradictoire avec le fait que la stimulation intellectuelle ralentit la maladie d’Alzeimer, mais, pour Subhojit Roy, l’un des coauteurs de l’étude, une hypothèse pourrait lever la contradiction : selon cette hypothèse – controversée –, la maladie résulterait le plus souvent d’une agrégation des peptides bêta-amyloïdes dans le réseau neuronal dit du mode par défaut, qui s’active quand on ne pense à rien et s’éteint quand on se concentre. Dès lors, l’activité intellectuelle diminuerait l’activité neuronale dans cette zone et y ralentirait l’agrégation des peptides.
Quoi qu’il en soit, lorsque les chercheurs ont stimulé les neurones, de nombreux vésicules ont fusionné, conduisant au rapprochement et à l’interaction des protéines APP et des enzymes BACE-1. Des analyses post-mortem du cerveau de victimes humaines de la maladie d’Alzheimer suggèrent aussi que les vésicules de stockage de ces deux molécules ont fusionné. Ce processus pourrait donc jouer un rôle dans la maladie d’Alzheimer. Reste à déterminer pourquoi la compartimentation n’est prise en défaut que chez les malades.